2023年8月31日,由市场监管总局、国家卫生健康委、国家中医药局联合发布《允许保健食品声称的保健功能目录 非营养素补充剂(2023年版)》(以下简称《保健功能目录(2023年版)》)及配套文件公告,规范保健功能声称管理,落实企业保健功能声称和研发评价主体责任,促进产业创新和高质量发展。


据了解,纳入《保健功能目录(2023年版)》的24种保健功能声称,均为历史曾批准、社会共识程度高、国际上有类似功能声称的保健功能声称。《保健功能目录(2023年版)》配套文件主要包括《保健食品功能检验与评价技术指导原则》《保健食品功能检验与评价方法》以及《保健食品人群试食试验伦理审查工作指导原则》等。
市场监管总局遵照“科学合理、有效衔接、平稳过渡、规范调整”的原则,分别于2019年3月、2020年11月、2022年1月三次面向社会公开征求意见,对《保健功能目录(2023年版)》及配套文件进行修改完善。《保健功能目录(2023年版)》将原来的27种保健功能调整为24种,删除了“改善生长发育”“促进泌乳”“改善皮肤油分”等3种共识程度不高、健康需求不明晰的保健功能,将功能评价方法由强制方法调整为推荐方法,落实企业研发评价主体责任,充分发挥社会资源科研优势。
我公司整理了非营养素补充剂的新旧保健功能声称变化表,请看附表:


自《保健功能目录(2023年版)》及配套文件发布之日起5年内,已注册备案的非营养素补充剂保健食品需按照《保健食品原料目录与保健功能目录管理办法》和《保健功能目录(2023年版)》的规定予以规范。为确保平稳有序实施,总局特殊食品司会同食品审评中心及时制订配套解读,对新旧功能学评价方法的实质性异同逐一比对论证,在配套解读中明确了保健功能名称的衔接和功能学评价方法的衔接措施,为规范不同历史时期批准的保健功能提供技术依据。同时,设立5年过渡期,对于暂未纳入保健功能目录的,允许企业在开展相关研究的基础上,根据《保健食品原料目录和保健功能目录管理办法》申请将相应保健功能纳入保健功能目录,落实企业功能声称和研发评价的主体责任,实现保健功能目录的科学动态管理。
——以上转载自SAMR官网。
在《保健功能目录(2023年版)》及配套文件解读中,对保健功能已列入《保健功能目录(2023年版)》的产品、保健功能未列入《保健功能目录(2023年版)》的产品、注册证书“无有效期和无产品技术要求”的产品,有详细的过渡措施,要求在5年内完成转换或增补,让产品的保健功能注册证书等规范,与现行有效的保持一致。具体如下:
对于已批准注册的产品中注册证书有下列情况之一的产品,省级市场监管部门应当根据产品实际生产的技术要求和监管情况,依据现行法律法规提出产品换发注册证书的意见,由注册人向审评机构申请转换或增补《保健功能目录(2023年版)》内的保健功能声称,审评机构按照《食品安全法》及有关规定开展审评换证工作。

——上表摘自《允许保健食品声称的保健功能目录 非营养素补充剂(2023年版)》及配套文件解读中的附表《新旧保健功能声称对应关系和功能评价衔接要求》
对功能学试验情况的注解:
一、原功能学试验评价依据为原卫生部发布《保健食品功能学评价程序和检验方法(1996版)》,有8类保健食品,需重新开展的功能学试验。
——大多是2003年及之前获得注册证书的产品,功能方法用的1996版的方法,或将需要补做功能学试验。
二、《保健食品功能检验与评价方法(2023年版)》是在《保健食品检验与评价技术规范(2003年版)》和原食品药品监管局2012年修订发布的《关于印发抗氧化功能评价方法9个保健功能评价方法的通知》基础上修订形成,原功能学试验报告评价要求和标准为《保健食品检验与评价技术规范(2003年版)》或原食品药品监管局2012年修订发布的《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》的,不需提供保健功能再评价资料。
——是2003年至2023年获得注册证书的产品,功能方法采用2003年版或者2012年版方法的,均不需要补做功能学试验或者提供功能再评价资料。
三、参照既往再注册产品保健功能评价管理要求,原功能学试验报告评价要求和标准低于现行标准要求的,新旧保健功能声称调整时,需提供相应产品的保健功能再评价资料:
1.第三方检验机构出具的上市后人群食用功能学评价研究报告,数据采集管理、分析应当规范、真实、可溯源,并对产品的保健功能提供有效技术支撑;
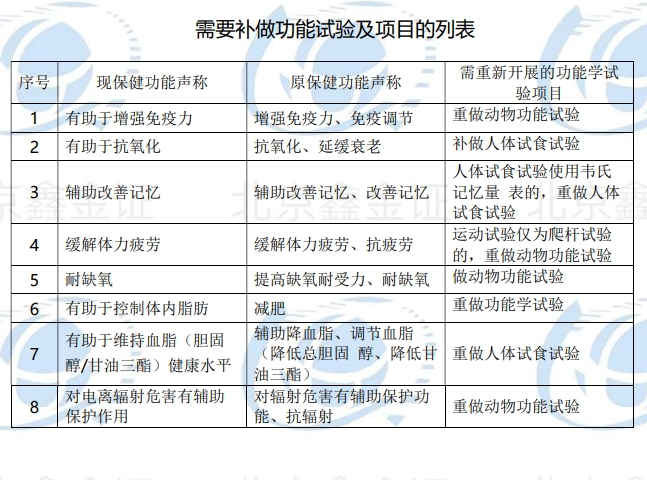
2.无法提供上市后人群食用功能学评价研究报告的,可提供按照《保健食品功能检验与评价方法(2023年版)》、原食品药品监管局2012年修订发布的《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》或《保健食品检验与评价技术规范(2003年版)》重做的功能学试验报告,其中,原功能学试验报告评价要求和标准为《保健食品功能学评价程序和检验方法(1996版)》的,需重新开展的功能学试验项目见“需要补做功能试验及项目的列表”,未列入的保健功能不需提供保健功能再评价资料。
——已经获批的产品,有8种保健功能的产品,可查询原注册或再注册申报时的功能学试验资料,原功能学试验报告评价要求和标准低于现行标准要求的,需要对保健功能再评价或者重做动物功能试验后,才可以调整保健功能声称。
期望未来保健食品的管理越来越规范,有利于保健食品证书持有人,也有益于广大的民众!
——紫色字是我公司对法规阅读后的注解,可供参考。每个产品需要结合注册证书和申报资料具体情况具体分析。如有需求,可随时咨询和联系本公司。
注:本文为本公司原创,如有转载,请注明出处,谢谢!

